Estructura de los átomos: Estructura electrónica
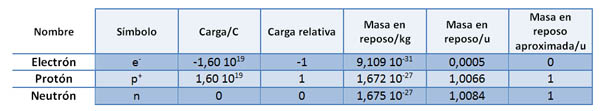
En la Física y Química de 1º de Bachillerato ya has estudiado los aspectos básicos de la estructura atómica, que se establecieron entre finales del siglo XIX y principios del XX. En la tabla siguiente se resumen las características de las partículas fundamentales.
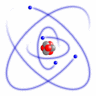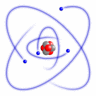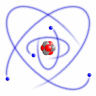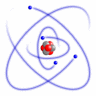
Recordarás que el modelo nuclear de Rutherford (1911) proponía que los electrones giraban alrededor del núcleo en órbitas circulares. En el núcleo central se encontraban los protones (los neutrones no se descubrieron hasta 1932).
|
 |
| Imagen 1 Debianux, GNU |
Imagen 2 Elaboración propia |
También sabes que la partícula que caracteriza a los elementos químicos es el número de protones que hay en el núcleo, magnitud llamada número atómico (que se presenta con la letra Z). Recordarás que hay átomos de un mismo elemento que pueden tener diferente número de neutrones; se habla entonces de isótopos. Por otro lado, también hay átomos de un mismo elemento que pueden diferir en el número de electrones; así se habla de cationes (iones positivos, porque han perdido electrones) o aniones (iones negativos, porque han ganado electrones).
Sin embargo, debes tener presente que el modelo actual se utiliza porque explica adecuadamente las observaciones experimentales, ya que los modelos fueron cambiando conforme se iban descubriendo nuevos hechos que exigían su modificación.
En este tema vas a profundizar en algunos aspectos, sobre todo en la necesidad de la aplicación de la mecánica cuántica ondulatoria a la explicación de los estados posibles de los electrones en los átomos.
Para comenzar, seguro que no te viene mal resolver algunas cuestiones relacionadas con el número de partículas en átomos o iones. Recuerda que en la formación de iones se ganan o pierden electrones, pero no protones, que están en el núcleo.
|
|
| Simulación 1 Educaplus, Creative commons |
|
| Imagen 3 Tungsten, Dominio público |
¿Por qué es estable el núcleo?
Si te paras a pensar un momento, seguro que te das cuenta de por qué se ha planteado la pregunta. Efectivamente, en el núcleo hay protones, de carga positiva, concentrados en un volumen muy pequeño, ya que el radio del núcleo viene a ser la diezmilésima del radio del átomo. Por tanto, ¡las fuerzas repulsivas deben ser enormes!
Pero la presencia de neutrones en el núcleo estabiliza los núcleos mediante fuerzas atractivas nucleares, muy intensas pero de corto alcance (teoría del campo mesónico de Yukawa). Eso sí, cuando el número de protones va siendo muy grande, los núcleos se van inestabilizando, convirtiéndose en radiactivos.
La Física nuclear estudia todos estos aspectos, tal y como se ve en la Física de 2º de Bachillerato.