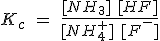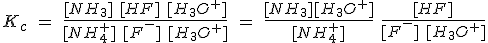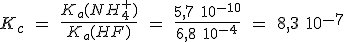Reacciones ácido-base: Equilibrios ácido-base
En el tema anterior se ha realizado una clasificación de la acidez y basicidad de las sustancias en unas circunstancias muy concretas: en relación con el agua, y en disoluciones acuosas diluidas a 25 ºC. El parámetro que permite comparar la fuerza de dos ácidos o de dos bases es la constante de su equilibrio de disociación (Ka ó Kb).
En este tema vas a utilizar las Ka y Kb para determinar las concentraciones de todas las especies químicas presentes en un equilibrio ácido-base y calcular el valor del pH de las disoluciones, tanto de una sustancia como de una mezcla de sustancias.
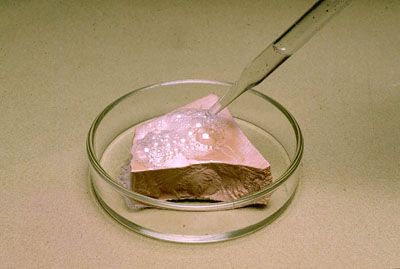 |
| Imagen 1 ISFTIC, Creative commons |
Predicción de reacciones ácido-base
Los valores de las constantes de acidez permiten predecir en qué
sentido estará desplazado un equilibrio de transferencia de protones. Observa la imagen, en la que se ve el ataque del HCl al CaCO3, en el que se disuelve el trozo de mármol y se forman burbujas de CO2.
¿Por qué se produce la reacción? Ten en cuenta que el HCl es un ácido fuerte, y que el H2CO3 es un ácido débil. Por tanto, el CO32- es una base fuerte, con apreciable tendencia a captar los protones que cede el HCl, con lo que las reacciones producidas son:
2 HCl(aq) + CaCO3(s) ↔ CaCl2(aq) + H2CO3(aq)
H2CO3(aq) ↔ H2O(l) + CO2(g)
Así que ya sabes: ¡no se te ocurra intentar limpiar con salfumán (disolución de HCl concentrado, que hay que manejar con muchísimo cuidado) una encimera de mármol, cuyo principal componente es CaCO3!