1. Principios termodinámicos. Definiciones.
Sistema: Porción de universo sometida a estudio termodinámico.
Entorno: Porción del universo que no es el sistema.
Energía interna: Energía total que posee el sistema. En los gases ideales, no hay interacciones entre las partículas que lo componen, por lo tanto la energía interna depende exclusivamente de la temperatura del sistema.
Temperatura: Medida macroscópica promedio de la energía cinética que poseen las partículas del sistema.
Trabajo (W): Quedó definido en el tema anterior. En el caso de las máquinas térmicas consideraremos el trabajo de expansión. Este trabajo es la energía intercambiada entre el sistema y su entorno por medio de una variación en el volumen del sistema.
Calor (Q): Flujo de energía entre el sistema y su entorno. Para su transmisión es necesaria una diferencia de temperatura entre ambos. El calor es un flujo de energía desde un cuerpo a temperatura superior a otro cuerpo que está a una temperatura inferior.
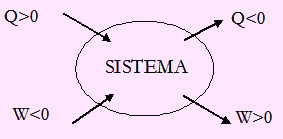 |
| Imagen 3. Recurso propio. |
- Trabajo positivo: Trabajo hecho por el sistema, comunica energía al entorno.
- Trabajo negativo: Trabajo hecho sobre el sistema, toma energía del entorno.
- Calor positivo: Calor comunicado al sistema, toma energía del entorno.
- Calor negativo: Calor comunicado por el sistema, se aporta energía al entorno.
La termodinámica basa todo su desarrollo en tres principios. Estos principios se toman como ciertos aunque no pueden ser demostrados, se aceptan ya que no se ha encontado ningún proceso termodinámico que no los cumpla.
En este tema haremos referencia a los dos primeros principios, que contituyen la base sobre la que se desarrollará el campo de los motores térmicos.
PRIMER PRINCIPIO DE LA TERMODINÁMICA
En toda transformación termodinámica el incremento de energía interna del sistema es igual al calor suministrado menos el trabajo realizado por el mismo.
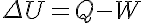
Por transformación termodinámica se entiende cualquier proceso en el que un sistema pasa de un estado inicial a un estado final en el que alguna de las propiedades que sirven para describirlo ha variado.
Un aspecto muy importante a tener en cuenta es que hay propiedades cuyo valor solamente depende del estado en que se encuentra el sistema. Estas propiedades reciben el nombre de funciones de estado.
La energía interna es una función de estado. También lo son la presión, la temperatura, el volumen...
Sin embargo el calor y el trabajo no lo son. Esto es así por dos motivos. En primer lugar calor y trabajo no son propiedades del sistema sino que son formas de energía en tránsito. En segundo lugar su valor en una transformación dependerá del camino seguido, tal y como se vio en el tema anterior cuando se presento el concepto Trabajo.
Las funciones de estado de un sistema en equilibrio estarán relacionadas por medio de las ecuaciones de estado. En el caso de los gases ideales, esta ecuación es la ecuación de estado de los gases ideales:
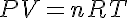
Donde P es la presión del sistema, V el volumen, n el número de moles gaseosos contenidos en el sistema, T la temperatura y R la constante de los gases ideales, cuyo valor en unidades SI es 8.314 J/mol.K
Como veremos más adelante las máquinas térmicas funcionan repitiendo ciclos termodinámicos. Un ciclo termodinámico es todo proceso en el que un sistema parte de un estado inicial, sufre una serie de transformaciones termodinámicas tras las cuales llega a un estado final igual al inicial. Según esto y dado que la energía interna es una función de estado, en todo ciclo termodinámico se cumplirán:
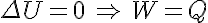
Es decir la energía interna no variará y el calor neto comunicado al sistema será igual al trabajo realizado por el mismo.
SEGUNDO PRINCIPIO DE LA TERMODINAMICA
La transformación integra en un proceso termodinámico de calor en trabajo o viceversa es imposible.
 |
| Imagen 4. Monografías. Copyright |
Históricamente se pensaba que calor y energía eran dos tipos de magnitudes diferentes, por ello se medían en unidades distintas.
La unidad de calor era la caloría. (Una caloría es la cantidad de calor necesaria para elevar la temperatura de un gramo de agua destilada desde 14,5ºC a 15,5ºC.)
En un primer momento se pensaba que el calor era un fluido (denominado calórico) que impregnaba los cuerpos y era responsable del calor que se trasegaba entere ellos cuando se ponían en contacto.
Por medio de un experimento Joule demostró que el calor es una forma de energía, que era posible obtener a partir de energía mecánica.
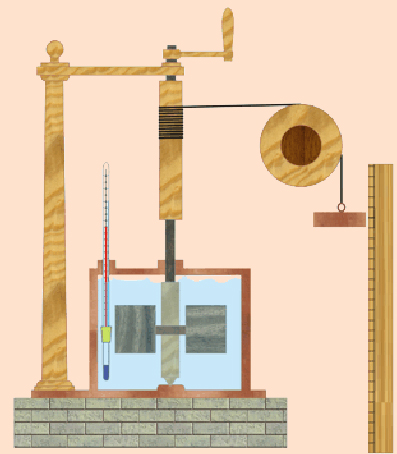
Joule trató de demostrar que era posible aumentar la temperatura del agua transfiriéndole energía mecánica. Para lo que construyó una máquina parecida a la representada en la figura. Dentro de un recipiente se introduce 1 kg de agua a 14,5ºC, en el interior se sitúa un eje solidario a unas aspas, conectadas a una masa, por medio de una cuerda, que tiende a caer por gravedad, al descender ésta a una velocidad constante, las aspas giran debido a la energía potencial de la masa. El giro de las aspas se convertía en calor, aumentando la temperatura del agua.
Tras este experimento Joule comprobó que para conseguir elevar la temperatura del agua 1ºC, es decir para conseguir una energía de 1000 calorías, debía disminuir, la energía potencial de la masa en 4180 Julios. Por lo que dedujo que la equivalencia entre las unidades de calor y energía es:
4180 J= 1000 cal=1 Kcal, es decir 1 cal=4,18 J, o bien, 1 J=0,24 cal.