2.1 Tamaño de los átomos e iones
 |
| Imagen 15. Elaboración propia |
|
|
| Animación 3. Jesús Peñas Permiso uso educativo |
El radio atómico es una propiedad periódica que varía de la siguiente forma:
En un grupo: dado que el radio atómico depende de la distancia al núcleo del electrón más externo, éste aumenta con el número atómico (Z). Como al descender en un grupo Z aumenta, el radio atómico es mayor. Además esta variación se ve reforzada puesto que con valores mayores de Z, al aumentar el número de capas electrónicas, la atracción del núcleo queda apantallada y los electrones externos se ven menos atraídos, alejándose más y provocando un aumento en el radio atómico. Así pues, el radio atómico aumenta conforme descendemos en un grupo.
En un periodo: el radio atómico disminuye al aumentar el número atómico, pues aunque el último electrón se encuentre en el mismo nivel energético (capa), el núcleo tiene un protón más, de forma que lo atrae con más fuerza. Por tanto, el radio atómico disminuye conforme avanzamos en un periodo.
En resumen, la variación del radio atómico referida a la posición en la tabla periódica puede observarse en la siguiente imagen, donde la flecha indica el aumento del radio:
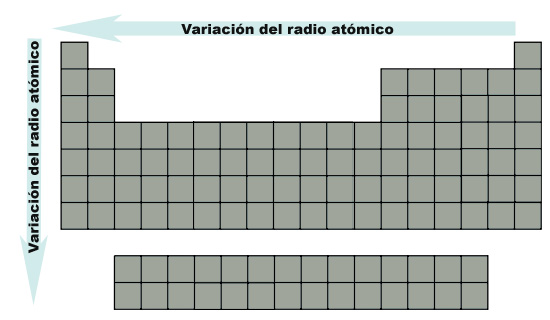 |
| Imagen 16. Elaboración propia |
Ordena según su tamaño los átomos siguientes:
N, Be, C, He, F
- Los cationes (iones con carga positiva): su radio atómico es siempre menor que el del átomo del que provienen, pues tienen un electrón menos e igual carga nuclear.
- Los aniones (iones con carga negativa): su radio atómico es siempre mayor que el del átomo del que provienen, pues tienen un electrón más e igual carga nuclear.
Ordena en función de su tamaño las siguientes especies químicas:
Na+, Ne, O2-, Mg2+ y F-