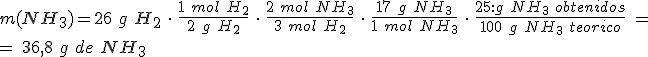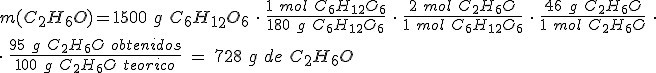5. Rendimiento de la reacción
 |
| Imagen 19. Sebastian Ritter. Creative commons |
En general, cuando se produce una reacción química se obtienen menores cantidades de producto de las que cabria esperar teóricamente por la estequiometría de la reacción.
Los motivos son diversos, como pueden ser:
-
La reacción se produce en condiciones inadecuadas.
-
Se pierde algo de la sustancia al manipularla.
-
Existen reacciones alternativas o secundarias que dan lugar a
productos no deseados.
Además, hay muchos casos en los que la conversión de reactivos en productos no es total por razones energéticas, independientemente de que se den las circunstancias anteriores.
Se define el rendimiento de una reacción química como:
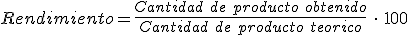
 |
| Imagen 20. Benjah-bmm27, dominio público |
Ahora vas a tener en cuenta el rendimiento en una reacción concreta.
Un método usado para reducir emisiones de cloruro de hidrógeno, que fue utilizado para obtener cloro antes de los procesos electrolíticos, es la oxidación directa del HCl con el oxígeno, con el empleo de un catalizador y a alta temperatura.
La ecuación química ajustada del proceso es:
4 HCl + O2 → 2 Cl2 + 2 H2O
Partiendo de 27 g de HCl y con suficiente dioxígeno, ¿cuál es la masa de Cl2 que obtendrás si el rendimiento de la reacción es del 36 % ? Masas atómicas relativas: H = 1 ; O = 16 ; Cl = 35,5.
La secuencia de operaciones incluirá un factor que tenga en cuenta el rendimiento de la reacción:
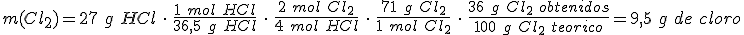
 |
| Imagen 21. Unknown, Creative commons |
| |
| Imagen 22. Agne27. Creative commons |
Masas atómicas relativas: C = 12 ; O = 16 ; H = 1